来源:宝创日期:2021-09-07(793)
1、新冠疫情未散,结核仍须警惕
新冠疫情仍在全球肆虐,而另一个肆虐几千年的慢性呼吸道传染病-结核病也需高度警惕,这个无情的“白色瘟疫“至今仍是全球传播最广泛和致死率最高的传染病之一,中国每年结核发病数是新冠肺炎患者(2020年总数)的十倍左右。世界卫生组织(WHO)发布的《2020年全球结核病报告》指出,结核病目前是全球导致死亡的十大原因之一,且2007年以来一直位居单一传染性疾病死因之首。2019年,全球新发结核病患者约996万人,发病率为130/10万。中国结核病新发患者数为83.3万人,占比8.4%,居全球结核病高负担国家中的第3位[1]。

图1 2019年全球结核病数据
新型冠状病毒大流行之下,卫生服务受到干扰,发现和治疗结核患者人数下降。对肺结核患者治疗和督导管理也带来了明显影响,最令人担心的是,肺结核患者因不能及时就诊而导致治疗中断,特别是耐多药肺结核患者,引起结核病死亡人数将升高。有可能逆转2019年底前全球减轻结核病负担所取得的进展,2035年终止结核病流行的目标也将面临挑战。
2、结核潜伏性感染急需早期识别、检测和预防治疗
结核病是由结核分枝杆菌(M. tuberculosis,MTB)引起的感染,引起结核原发性感染后,仅有少数患者出现急性症状,多数患者(95%)的原发感染是无症状的,随后进入潜伏性结核感染(LTBI)的休眠期状态。潜伏性感染人群的数量庞大且隐秘,全球结核潜伏感染人群接近20亿,在中国,结核潜伏感染者约为3.5亿[2,3]。

图2 结核潜伏感染人群如同海面之下的庞大“冰山”
LTBI 人群是一个庞大的潜在患者库,约 5%~10%的人会在一生中发展成为活动性结核病患者,成为新的结核病传染源。加强潜伏期结核人群的筛查和治疗以阻断潜伏感染者转化进展为活动性感染者,则发病率的下降速度会远超仅单独治疗活动性结核。既往研究表明,针对LTBl人群开展预防性治疗可以实现60%~90%的保护效果[2]。为此我国也发布了《遏制结核病行动计划(2019-2022年)》、《中国结核病预防控制工作技术规范(2020年版)》都将结核病预防性治疗作为结核病综合防治的重要组成部分[4,5]。针对肺结核的密切接触者、HIV感染者等高危人群开展结核潜伏感染检测和预防性治疗是实现“终止结核病策略“的重要手段[4,6]。
3、结核检测方法
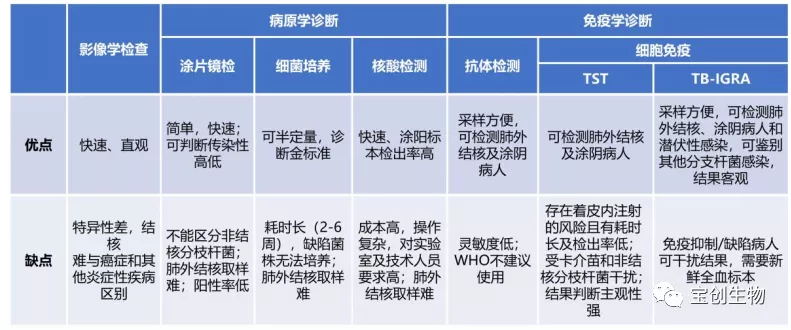
目前,临床诊断结核病除了结合临床症状和病史资料外,还依靠影像学检查、病原学诊断(涂片镜检、细菌培养、分子生物学检测)、免疫学检查(结核菌素皮肤试验(TST)、结核γ干扰素释放试验(TB-IGRAs))等方法进行辅助检查,见表1[7,8]。
表1 结核检测方法比较
4、γ-干扰素释放试验(interferon-γ release assays,IGRAs)原理
IGRA通过检测全血或分离自全血的单核细胞在MTB特异性抗原早期分泌抗原靶6(ESAT-6) 和培养基滤过蛋白-10(CFP-10)刺激下产生的γ-干扰素,判断受试者是否感染结核分枝杆菌。目前较成熟的IGRA方法有2 种,其对应的方法和试剂盒已先后被美国FDA、我国NMPA批准应用于临床。
(1)采用酶联免疫吸附试验(ELISA)、免疫荧光层析法、化学发光法检测全血中致敏T细胞再次受到 MTB 特异性抗原刺激后释放的 γ-干扰素水平,称之为全血检测或结核感染 T细胞免疫检测。
(2)采用酶联免疫斑点技术(ELISPOT)测定在 MTB 特异性抗原刺激下,计数外周血单个核细胞中能够释放γ-干扰素的效应T细胞数量,称之为细胞检测或结核感染 T细胞检测[9]。
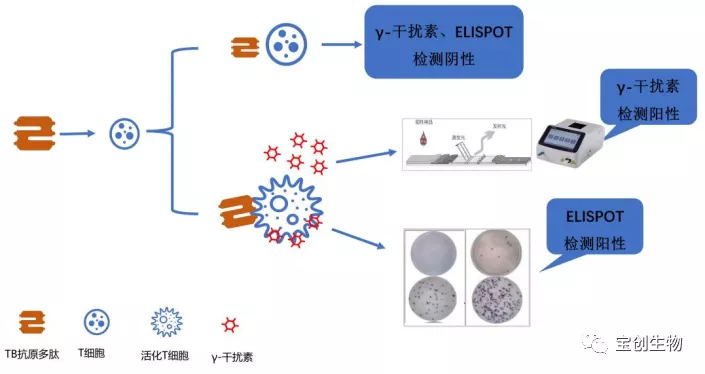
图3 γ-干扰素释放试验原理示意图
Ø 基于特异性细胞免疫反应,具有高灵敏度,结核感染检出率达到85%以上,可用于潜伏感染的检测,有效提高早期感染检出能力;
Ø 采用结核分枝杆菌特异性抗原,排除卡介苗接种的影响,同时可鉴别非结核分枝杆菌肺部感染与肺结核;
Ø 全血样本体外检测,肺内结核与肺外结核都可检测,检测过程更安全;
Ø 采用定量检测系统,结果客观易判读,适用于治疗效果跟踪及潜伏性感染筛查的首选;
5、IGRAs临床应用
1)结核感染的辅助诊断
结核病例的发现和及时治疗是结核病控制的基石,国内多数文献报道的IGRAs敏感度和特异度在70%以上,优于TST,检出阳性率也明显高于涂片、菌培等常规检测方法,可用于不明原因发热病人的结核或症状相似的其他肺部疾病的鉴别诊断。我国肺结核患者中菌阴肺结核所占比例较高,IGRAs在活动性结核尤其在菌阴结核病中具有诊断价值。《γ-干扰素释放试验在中国应用》建议:IGRAs不能用于确诊或排除活动性结核病,但对缺少细菌学诊断依据的活动性结核病(如菌阴肺结核等),IGRAs 可在常规诊断依据的基础上,起到补充或辅助诊断的作用[9,10]。
2)辅助诊断肺外结核
肺外结核属于多系统、多脏器、多部位的结核病变,如淋巴结、骨、泌尿生殖等结核,近年来的患者数量呈逐年上升趋势。诊断受到临床样本获取相对困难、肺外结核含菌量少等原因无法获得病原学或病理确诊,IGRAs临床样品容易获取,并且在肺外结核的诊断中具有较高灵敏度[10,11]。
3)筛查潜伏性结核感染
LTBl既无结核病相关症状,也没有细菌学和影像学方面的结核活动证据。目前对LTBI的诊断多为间接,依赖于机体对MTB抗原所产生的特异性免疫反应的检测[2]。WHO 强烈推荐 IGRAs 应当在部分资源条件许可的高收入和中高收入国家用于检测LTBI[10]。《γ-干扰素释放试验在中国应用》建议:TST与IGRAs均可用于LTBI 的诊断和追踪,若考虑到TST试验检测结果可能受卡介苗接种或非结核杆菌影响时,可对TST试验阳性者进一步采用IGRAs 帮助确认[9]。
对潜伏感染的高危人群,扩大进行主动筛查的覆盖面,包括:肺结核患者的密切接触者、≥65岁老年人、糖尿病患者、吸烟者、医务工作者等高危人群。类风湿关节炎等自身免疫性疾病和器官移植患者在接受糖皮质激素或 TNF-α拮抗剂治疗可导致免疫功能缺陷,这类患者也是 LTBI发展为结核病的高风险人群,有必要用IGRAs进行筛查LTBI[4,9]。另外HIV感染是 LTBI进展为活动性结核病的高危因素,临床上应用IGRAs对 HIV 感染人群进行 LTBI 筛查非常重要,IGRAs的阴性值可较好地排除MTB感染,避免艾滋病患者在治疗过程中发生结核病[9]。
6、产品信息
宝创生物推出新品:结核分枝杆菌特异性细胞免疫反应检测试剂盒(荧光免疫层析法),已获国家药品监督管理局三类医疗器械注册证。本试剂盒基于IGRAs原理,通过免疫荧光层析定量检测IFN- γ,判断结核感染情况。经广州市胸科医院、湖南省胸科医院、湖北省人民医院、武汉市肺科医院等多家知名专科与综合三甲医院进行了大规模验证,结果可靠、与临床诊断符合性高,获得了上述医院的好评和认可。
优势
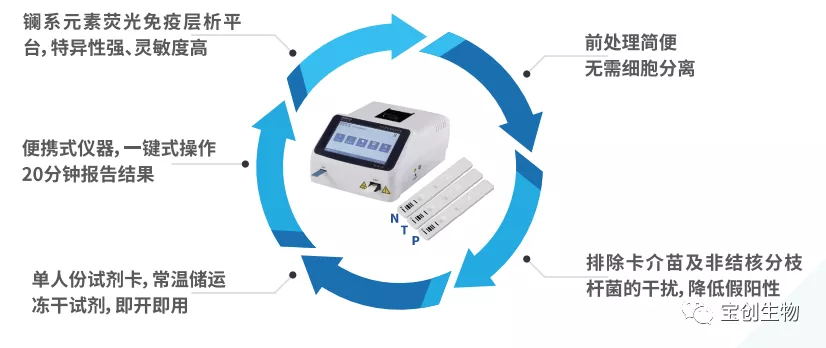
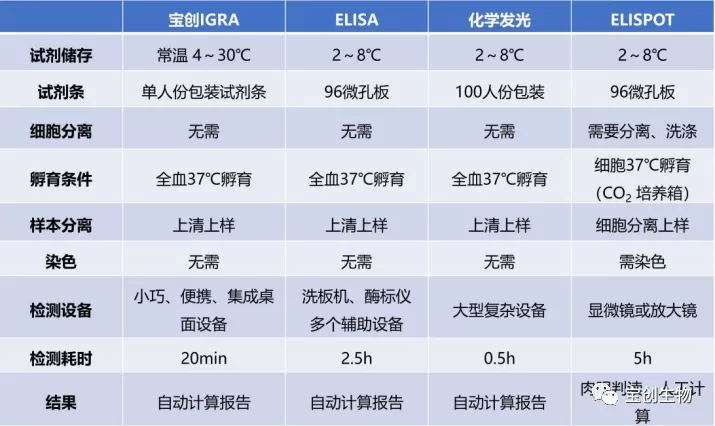
宝创生物结核IGRA检测方案与其它方法的对比:
配套宝创生物的桌面型免疫荧光定量检测平台,打造全新的结核感染细胞免疫检测方案,尤其匹配BCG广泛接种的中国国情,适应各级医疗单位装备和应用,充分发挥小巧便捷、操作便捷、取样方便、抗干扰强、结果客观、单人份试剂等优势,助力国家实现“十三五”结核病防治规划策略中提出的2035年遏制和终止结核病的流行。
参考文献:
[1] World Health Organization.Global tuberculosis report 2020. Geneva: World Health Organization,2020.
[2] 李果, 庞先琼, 徐华,等. 潜伏性结核感染诊治进展[J]. 中国防痨杂志 2021年43卷1期, 91-95页, ISTIC CA, 2021.
[3]佚名. HIV合并结核分枝杆菌感染诊治专家共识[J]. 中华临床感染病杂志, 2017(2).
[4] 中华人民共和国国家卫生健康委员会.《遏制结核病行动计划(2019-202年).国卫疾控发﹝2019﹞41号 .2020- 05-31.
[5] 中华人民共和国国家卫生健康委员会.中国结核病预防控制工作技术规范(2020年版).国卫办疾控函[2020]279号.2020- 04-02.
[6] 高磊, 金奇. 关口前移:再谈结核分枝杆菌潜伏感染管理和暴露后干预[J]. 中国防痨杂志 2021年43卷3期, 201-203页, ISTIC CA, 2021.
[7] 吴弟梅综述, 阳萍审校. 结核病检查方法的研究进展[J]. 国际检验医学杂志, 2015(1):106-107.
[8] 李观华, 陈雪礼, 刘晓峰,等. 结核分枝杆菌6种检测方法的比较分析[J]. 当代医学, 2020, v.26;No.565(14):68-70.
[9] 《中华结核和呼吸杂志》编辑委员会 中华医学会结核病学分会. γ-干扰素释放试验在中国应用的建议[J]. 中华结核和呼吸杂志, 2014, 37(010):744-747.
[10] 史培, 徐凯进. γ-干扰素释放试验在结核病诊断中的应用及进展[J]. 医疗装备, 2019, 032(017):196-200.
[11] 朱洪柱. γ干扰素释放试验与结核菌素试验在肺外结核临床诊断中的价值对照研究[J]. 当代医学, 2020, v.26;No.584(33):83-85.